En este artículo vamos a hablar de aquello que nos rodea, que es la materia, vamos a estudiarla desde el punto de vista científico. Empezamos con una introducción sobre las magnitudes utilizadas en el estudio de la materia y posteriormente hablaremos ya propiamente de la materia. Explicaremos lo que es, su relación con la energía, profundizaremos hablando de la temperatura y aprenderemos a pasar de unas escalas a otras, haremos una clasificación de la materia y finalmente hablaremos de las disoluciones, del concepto de solubilidad y de las curvas de solubilidad.
La química es la ciencia que estudia las propiedades y transformaciones de la materia hasta el nivel atómico.
La física es la ciencia que estudia las magnitudes entendiendo por tales todo aquello que se puede medir.
Medir es comparar una magnitud con otra homogénea que tomamos como unidad.
Las unidades y magnitudes se agrupan en sistemas, y el sistema que se utiliza a nivel científico es el sistema internacional (SI) el cual tiene siete magnitudes fundamentales, dos complementarias y más de cuarenta derivadas.
Las magnitudes se pueden clasificar de muchas maneras.
-MAGNITUDES FUNDAMENTALES Y MAGNITUDES DERIVADAS:
Una magnitud es fundamental cuándo se define por si misma y derivada la que necesita de las fundamentales para su exacta comprensión.
En el sistema internacional las magnitudes fundamentales y sus unidades son:
MAGNITUD
|
UNIDAD
|
Longitud
|
Metro (m)
|
Masa
|
Kilogramo (Kg)
|
Tiempo
|
Segundo (s)
|
Cantidad de materia
|
Mol (mol)
|
Temperatura absoluta
|
Kelvin (K)
|
Intensidad de corriente
|
Amperio (A)
|
Intensidad luminosa
|
Candela (cd)
|
Las magnitudes complementarias y sus unidades son:
MAGNITUD
|
UNIDAD
|
Ángulo plano
|
Radián
|
Ángulo sólido
|
Extereo radián
|
Ejemplos de magnitudes derivadas y sus unidades:
MAGNITUD
|
UNIDAD
|
Presión
|
Pascales (Pa)
|
Fuerza
|
Newton (N)
|
Trabajo
|
Julios (J)
|
Velocidad
|
Metros/segundo (m/s)
|
Volumen
|
Metro cúbico (m3)
|
Superficie
|
Metro cuadrado (m2)
|
Aceleración
|
Metro/segundo cuadrado (m/s2)
|
-ECUACIÓN DE DIMENSIONES:
Es aquella que expresa una magnitud derivada en función de las fundamentales que la caracterizan. Se expresa mediante letras mayúsculas elevadas a exponentes positivos y negativos. Se expresa en forma de producto.
EJEMPLOS:
-MAGNITUDES INTENSIVAS Y EXTENSIVAS:
- Intensivas: Se dice que una magnitud es intensiva cuando solo depende de la naturaleza del sistema. Color, densidad …
- Extensivas: Se dice que una magnitud es extensiva cuando depende de la extensión o cantidad de dicho sistema. Volumen, masa…
-MAGNITUDES ESCALARES Y VECTORIALES:
- Magnitudes escalares: Son aquellas que quedan especificadas por un número y una unidad, por ejemplo: 1h, 3g, 18ºC,5km,7 J…
- Magnitudes vectoriales: Son aquellas que además de un número y una unidad necesitan de un vector. Se entiende por vector un segmento orientado.
Partes de un vector:
- Punto de aplicación: Es el punto en el que se empieza a representar el vector.
- Módulo: Es la longitud del vector.
- Sentido: Indica hacia donde se dirige el vector y viene dado por la flecha.
- Dirección: Recta imaginaria sobre la que se apoya el vector.
Los vectores a su vez se pueden clasificar en fijos(tensión de una cuerda) y libres(velocidad de un vehículo).
-¿QUÉ ES LA MATERIA?
La materia es todo aquello que nos rodea. Se denomina materia todo aquello que tiene masa y que ocupa un lugar en el espacio, es decir un volumen.

Las propiedades de la materia se clasifican en dos grupos: generales (masa y volumen) y específicas (color, dureza, etc).
La materia se presenta en tres estados de agregación: sólido, líquido y gaseoso. Cuándo las partículas de una sustancia ganan o pierden energía, la sustancia puede cambiar de estado. En el siguiente esquema se ven los cambios de estado de agregación que se pueden producir:
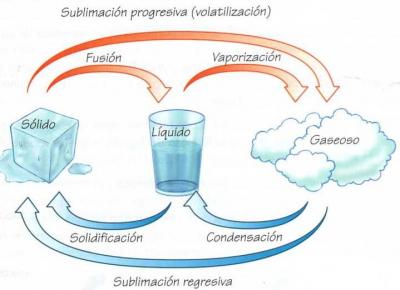
Un ejemplo sublimación progresiva es el hielo seco utilizado en los conciertos. El resto de cambios de estado de agregación pienso que es fácil que se nos ocurran.
Se define energía como la capacidad de realizar trabajo. Se conoce energía cinética como la energía asociada al movimiento y energía potencial como la energía asociada a la posición. Formas de la energía cinética y de la energía potencial son la energía térmica, luminosa, química y nuclear.
Einstein, en su teoría de la relatividad estableció que existe una equivalencia entre la materia y la energía. La materia y la energía interaccionan ejemplos de esto son las plantas de energía química y las centrales eléctricas.
-CARACTERÍSTICAS DE LOS ESTADOS DE AGREGACIÓN:
-ESTADO SÓLIDO:
Se caracteriza porque las partículas que lo constituyen vibran entorno a posiciones fijas. Las fuerzas de atracción entre ellas son mucho mayores que las de repulsión. Adoptan forma y volumen fijos siendo incompresibles e influibles.
Pueden ser cristalinos (su enfriamiento es lento, y sus partículas han tenido tiempo de formar redes ordenadas) y amorfos "polvos" (tienen un enfriamiento rápido, las partículas no han tenido tiempo de ordenarse).
-ESTADO LÍQUIDO:
-ESTADO GAS:
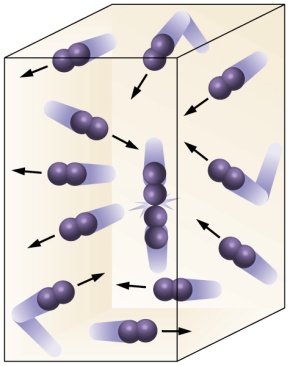
Sus partículas se trasladan en mucha mayor medida que los líquidos porque las fuerzas de repulsión entre ellos son mucho mayores que las de atracción. Por ello también tienden a ocupar el máximo volumen posible y recogidos en un recipiente adoptan la forma de este. Son compresibles. Forman parte de los fluidos.
Las partículas en estado gaseoso presentan lo que se denomina difusión. La difusión consiste en lo siguiente: Las partículas de un gas se mueven tan rápida y aleatoriamente que se distribuyen en todas las direcciones hasta que encuentran la pared del recipiente que las contiene.
Las partículas en estado gaseoso presentan lo que se denomina difusión. La difusión consiste en lo siguiente: Las partículas de un gas se mueven tan rápida y aleatoriamente que se distribuyen en todas las direcciones hasta que encuentran la pared del recipiente que las contiene.
Para determinar el estado de agregación de la materia sólo necesitamos saber la temperatura a la que se encuentra. Se conocen como puntos de fusión y ebullición las temperaturas a las que las sustancias puras se cambian de estado. Se utilizan para: reconocer sustancias y para comprobar la pureza.
En la siguiente imagen se ven ilustradas las características de los distintos estados de agregación que hay a modo de resumen:
A continuación hay una serie de ejemplos resueltos sobre las escalas de medida de la temperatura:
En la siguiente imagen se ven ilustradas las características de los distintos estados de agregación que hay a modo de resumen:
-TEORÍA CINÉTICO-MOLECULAR:
Tanto las características de los estados de la materia como los procesos de cambio que en esta se suceden son explicados mediante la llamada teoría cinético-molecular que podemos resumir de la siguiente manera.
Una muestra gaseosa está constituida por un enorme número de partículas de tamaño muy pequeño y a unas distancias unas de otras mucho mayores que el citado tamaño. Las partículas se mueven en un Movimiento Rectilíneo Uniforme, caótico, y con choques perfectamente elásticos todo ello regido por unas fuerzas que pueden ser de atracción y de repulsión.

El estado de la materia en que se nos presenta una sustancia cualquiera depende para los sólidos y los líquidos que son incompresibles fundamentalmente de la temperatura mientras que en los gases para expresarlo correctamente hay que definir además la presión y el volumen a los que se encuentran. En general al aumentar la presión a igualdad de energía se disminuye el volumen y si este permanece constante la presión aumenta con la temperatura. En los sólidos y líquidos el volumen aumenta con mucha menor medida que en los gases con la temperatura mientras que permanece prácticamente constante con la presión.
La relación entre volumen, presión y temperatura para los gases viene definida mediante una serie de leyes que explicaré en otro artículo.
La presión nos indica el número de choques de una sustancia gaseosa con las paredes del recipiente que lo contiene por unidad de superficie.
El volumen es una característica intrínseca de la materia.
La temperatura nos dice la energía cinética media (energía asociada al movimiento) de las partículas.
-TEMPERATURA:
La temperatura de un sistema material se mide con termómetros, los cuales están basados en unas escalas térmicas, las cuales se basan en valores que se dan a propiedades características de determinadas sustancias como por ejemplo puntos de fusión y ebullición del agua. Según los valores que se den a estos puntos obtendremos las siguientes escalas (Centígrada y Fahrenheit) y sus grados correspondientes.
Las escalas anteriores son prácticas por fáciles de usar en el entorno cotidiano. Sin embargo en investigación, industria o cuándo sea imprescindible máxima fidelidad no es conveniente usarlas debido a que tienen una serie de inconvenientes, de entre los que uno de ellos es que están basadas en dos puntos fijos, las temperaturas de fusión y ebullición del agua que verdaderamente no lo son por depender por ejemplo de la presión.
Para evitar estos inconvenientes se plantean escalas absolutas de temperatura basadas en dos verdaderamente fijos: el 0 absoluto de temperatura, aquella temperatura inalcanzable a la cual la presión y por lo tanto la energía cinética de las partículas de un sistema sería 0, y el punto triple del agua, temperatura única a la cual el agua se presenta en sus tres estados a la vez. Dado a que el "tamaño" del kelvin y el del grado centígrado son prácticamente iguales se traslada la escala centígrada a la kelvin simplemente añadiendo 273.
A continuación se resumen las ecuaciones que se utilizan para pasar de unas escalas a otras.
A continuación hay una serie de ejemplos resueltos sobre las escalas de medida de la temperatura:
¡CUÁNDO HABLAMOS DE LOS KELVIN, NO SE HABLA DE GRADOS, NI SE PONE O DE SUPERÍNDICE!
-CLASIFICACIÓN DE LA MATERIA:
Una posible clasificación de la materia es la siguiente: Pura (simple, compuesta) y mezcla (homogénea, heterogénea).
-MATERIA PURA:
- Sustancia pura simple o elemento: Constituidas por una sola clase de átomos (átomos semejantes), no pudiéndose separar en otras sustancias más sencillas. Se dividen entre ellos en metales y no metales. Son todos los elementos que hay en la tabla periódica.
- Sustancia pura compuesta o compuesto químico: Está constituido por moléculas semejantes que se pueden descomponer en otras más sencillas por métodos químicos tradicionales.
-MEZCLAS:
Constan de dos o más sustancias químicas denominadas componentes de la mezcla. Se pueden dividir en mezclas homogéneas o disoluciones y mezclas heterogéneas.
- Mezclas homogéneas o disoluciones: Presentan una única fase. Se reconocen porque son transparentes, se puede ver a través de ellas. Son uniformes. Están formadas por dos o más sustancias puras. Ejemplos: Aire, petróleo crudo y el agua del mar.
 |
| Vista de la ría de Pontevedra desde Bueu (España) |
- Mezclas heterogéneas o simplemente mezclas: Presentan varias fases. Pueden ser dos fases en el mismo estado de agregación (por ejemplo una mezcla de garbanzos y lentejas) o dos fases que se encuentren en distinto estado de agregación (por ejemplo el barro).
DIFERENCIAS ENTRE COMPUESTO Y MEZCLA:
El compuesto químico está constituido exclusivamente por moléculas semejantes mientras que la mezcla al menos por dos clases diferentes de las mismas.
Las propiedades del compuesto le son características mientras que las de las mezclas dependen además de la proporción en la que se encuentran las sustancias.
En el compuesto hay enlaces químicos entre los átomos entre los átomos, mientras que en las mezclas no hay entre las moléculas.
Para descomponer un compuesto son necesarios procesos químicos mientras que para separar las mezclas basta con procedimientos físicos.
En los compuestos las proporciones entre átomos son fijas, mientras que en las mezclas son variables.
-DISOLUCIONES:
Mezcla homogénea y estable de dos o más sustancias puras. Una de ellas es el disolvente o fase dispersante que normalmente es la que se encuentra en mayor proporción y la otra, el soluto o fase dispersa es la que en general se encuentra en menor proporción.
Expresándonos coloquialmente: el soluto es lo que se va a disolver y el disolvente es en lo que se va a disolver.
Existen dos tipos de disoluciones, las disoluciones sólido-líquido, que es el caso de sulfato de cobre (II) en agua y las disoluciones líquido-líquido, que es el caso de ácido clorhídrico en agua.
No es sólo importante conocer el soluto y el disolvente de una disolución, sino saber la proporción en que estos se encuentran, es decir su concentración. La concentración hay muchas maneras de expresarla técnicamente, que hablaré de ellas en otro artículo.
Se dice que una disolución es diluida cuando la cantidad de soluto es muy pequeña con respecto a la que podría disolver el disolvente a una temperatura determinada. Una disolución concentrada es la que contiene gran cantidad de soluto para la de disolvente de que se trate.
Una disolución es insaturada cuándo la cantidad de soluto no es la máxima para la cantidad de disolvente que se tiene a una temperatura dada. Una disolución saturada es aquella que contiene la máxima cantidad de soluto para la cantidad de disolvente que se tiene a una temperatura dada. Una disolución sobresaturada es aquella que contiene mayor cantidad de soluto que el permitido por el disolvente a la temperatura que se encuentra. La adición de un pequeño cristal, un golpe o una vibración hacen que instantáneamente se deposite el exceso de soluto hasta la saturación.
Se conoce como solubilidad la cantidad máxima de un soluto que se puede disolver en el disolvente a una temperatura determinada, se expresa en g de soluto/100 g disolvente. La solubilidad de una sustancia a distintas temperaturas, son valores tabulados y se representan en una gráfica que se denomina curva de solubilidad.
A continuación veremos una curva de solubilidad que he elaborado yo misma, es la curva de solubilidad del nitrato de potasio.
Datos de solubilidad del nitrato de potasio a diferentes temperaturas:
Temperatura ºc
|
Solubilidad (g de soluto/100 mL agua)
|
0
|
13,3
|
10
|
20,9
|
20
|
31,6
|
30
|
45,8
|
40
|
63,9
|
50
|
85,5
|
60
|
110
|
70
|
138
|
80
|
169
|
90
|
202
|
100
|
246
|
Curva de solubilidad del nitrato de potasio:
Una práctica bastante frecuente en un laboratorio de química es la preparación de una disolución, en la siguiente presentación explicamos como se prepara:
Descubrirlaquimica. Estudiante de química en la USC
09/08/2014














